化学応用学専攻 博士後期課程3年の鈴木渓太さん(生物医化学研究室・小山文隆教授)と小山文隆教授(生命化学科)らのグループは、ヒトのキチナーゼ様タンパク質YKL-40(HC-gp39、CHI3L1とも呼ばれます)がキチンを認識し、キチナーゼとして働かない理由を生化学的、進化的に解明しました。この成果は、炎症性疾患や癌の治療に重要な知見を提供し、YKL-40の構造と機能の理解を深めるものです。この研究結果は、権威ある国際学術雑誌“The Journal of Biological Chemistry”に公開されました。
研究概要
YKL-40(別名:ヒト軟骨糖タンパク質-39 (HC-gp39) または CHI3L1)は、喘息、慢性閉塞性肺疾患(COPD)、炎症性腸疾患(IBD)、アルコール性肝硬変、アルツハイマー病、および様々ながんの患者で増加することが知られています。そのため、YKL-40はこれらの病気のバイオマーカーとして注目されており、その役割を解明することで新しい治療法の開発につながる可能性があります。
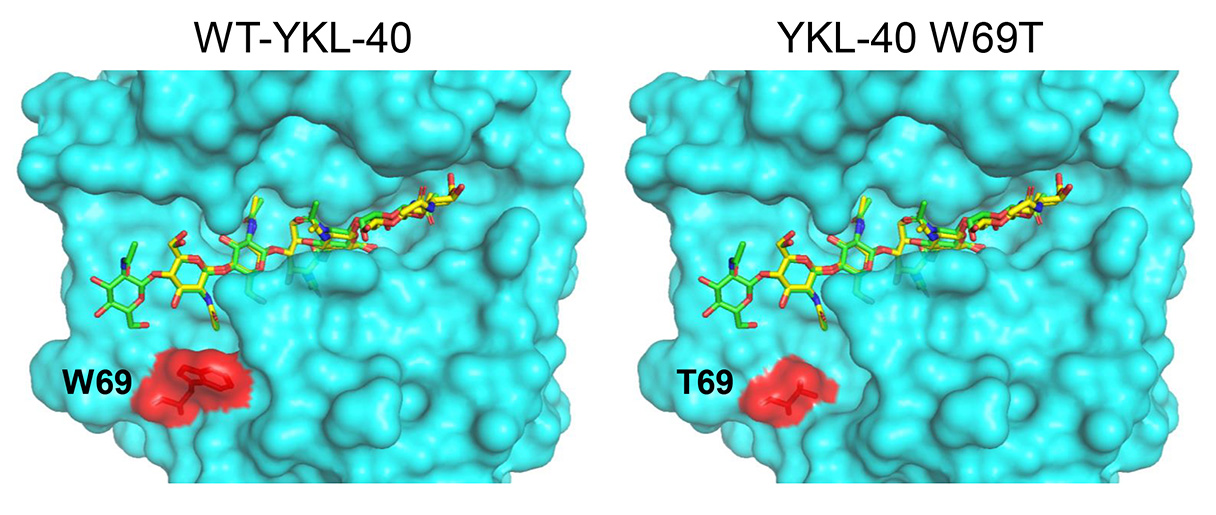
この研究では、YKL-40がキチンを認識する一方で、キチナーゼとして働かない理由を解明しました。YKL-40はキチンを強く結合しますが、特定のアミノ酸が変わることで分解能力を失っています。研究チームは、キメラタンパク質や変異体を用いて、YKL-40の分解活性の低下に関わるアミノ酸を特定しました。特に、YKL-40の69番目のアミノ酸であるトリプトファン(W)が重要な役割を果たしていることを発見しました。
図の説明:図の説明:YKL-40がキチナーゼ活性を失う原因に、69番目のアミノ酸であるトリプトファン(W69)が強く関わっています。図では、基質(GlcNAcオリゴマー)は黄色・緑色で、YKL-40のアミノ酸は水色で示されています。また、69番目のアミノ酸は赤色で示されています。
(左):野生型YKL-40(WT-YKL-40)の立体構造。
(右):WT-YKL-40にW69T変異を導入した変異体の立体構造。
トリプトファン(W)をスレオニン(T)に置換すると、YKL-40の構造が変わり、基質との相互作用が大きく変化することが示されています。
論文要旨の日本語訳は生命化学科ホームページをご覧ください。
■ヒトのキチナーゼ様タンパク質YKL-40がキチンを認識し、キチナーゼとして働かない理由を生化学的、進化的に解明
論文情報
論文情報
| 雑誌名 | The Journal of Biological Chemistry |
|---|---|
| 論文名 | Evolutionary insights into sequence modifications governing chitin recognition and chitinase inactivity in YKL-40 (HC-gp39, CHI3L1) J. Biol. Chem. 300, 107365 (2024) |
| URL | https://www.jbc.org/article/S0021-9258(24)01866-0/fulltext |
| 発表者 | 工学院大学 先進工学部 生命化学科 生物医化学研究室 Keita Suzuki, Kazuaki Okawa, Masashi Ohkura, Tomoki Kanaizumi, Takaki Kobayashi, Koro Takahashi, Hiromu Takei, Momo Otsuka, Eri Tabata, Peter O. Bauer, and Fumitaka Oyama |
掲載雑誌について
The Journal of Biological Chemistry (JBC) は、米国生化学・分子生物学会 (ASBMB) の Flagship Journalで、生化学や分子生物学の分野で重要な研究が多く掲載されています。1905年の創刊以来、生命科学の進歩に貢献してきました。2023年度のImpact Factorは4.8です。
研究費
日本学術振興会 科学研究費助成事業:基盤研究(B)(小山文隆)23H02532工学工学院大学:総合研究所プロジェクト研究費(小山文隆)