タンパク質の一つであるYm1は、炎症時に一時的に発現する酵素です。炎症箇所に移動して、傷ついた組織の修復を促進するとみられていますが、構造や作用の詳しい仕組みはまだわかってません。
工学院大学先進工学部生命化学科の客員研究員 大川一明博士と小山文隆教授らのグループは、マウスなどのげっ歯類で特徴的に発現しているキチナーゼ様タンパク質の一種である Ym1 のキチナーゼ活性が失われた原因を解明しました。今回の成果は、Ym1 をはじめとする不活性化酵素の生理的役割を理解するためのきっかけとなる発見です。この成果は、国際学術雑誌 “Protein Science” に公開されました。
大川博士は、これまでに、ほ乳類の酸性キチナーゼ (acidic chitinase, Chia) のキチン分解能と構造の関係を研究してきました。そして、ヒト Chia がマウスの Chia と比較して不活性化していることと、その原因を明らかにしました。今回報告した研究では、ほ乳類キチナーゼと同様の糖質分解酵素ファミリー18に属しているキチナーゼ様タンパク質の一種である Ym1 の不活性化原因を明らかにしました。この成果は、Ym1 のみならず、他のキチナーゼ様タンパク質であるYKL-40の不活性化機構の解明と、病態生理学的機能と医療目的(疾患マーカーなど)への利用を理解するための重要な研究だと評価されたと考えられます。
今回の研究は、テーマの発掘から学術的な問いの解明までを本学内で進めた”工学院大学を基盤とした研究“です。その研究が、評価が高く、影響力のある国際学術雑誌に掲載されたことは、素晴らしいことです。
研究概要
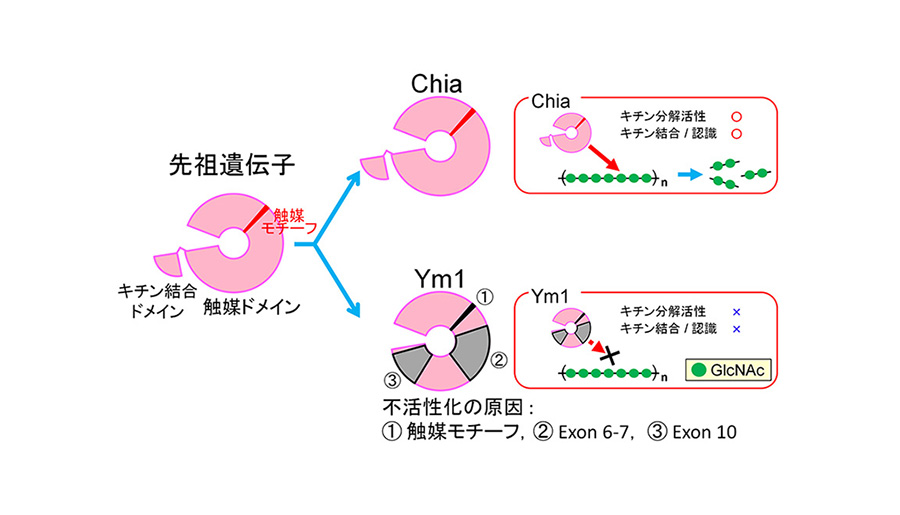
マウスで発現する Ym1 は、酸性キチナーゼ (Chia) と構造が類似していますが、キチン分解活性をまったく持たないタンパク質で、キチナーゼ様タンパク質と呼ばれています。Ym1 は Chia と同様に喘息および寄生虫感染症のマウスの肺で過剰発現しますが、酵素活性のないタンパク質が、これらの疾患に対してどのような役割を果たすのかは解明されていません。この研究は、Ym1 の酵素活性が喪失した原因を明らかにしました。これまで、Ym1 を含むキチナーゼ様タンパク質は、触媒モチーフへの変異によって不活性化したと考えられてきました。しかし実際には、① 触媒残基、② Exons 6 - 7、③ Exon 10 の 3 つの領域に多数のアミノ酸置換が生じ、Ym1 は不活性化していました。また、これらの領域は基質認識と結合にも関与していました。さらに、進化学的解析により、 Ym1 が Chia よりも積極的にアミノ酸置換を蓄積するように進化していることが分かりました。これらの結果から本研究では、「Ym1 が進化の過程で、キチン認識、結合、および分解能力に関与する領域に多数のアミノ酸置換が生じ、不可逆的に不活性化した」と結論づけました。
ほ乳類は、さまざまな病理学的条件下で過剰発現する YKL-40 などのキチナーゼ様遺伝子を複数有しています。本研究は、YKL-40の病態生理学的機能と医療へ利用するための新しい道を開きます。
論文情報
| 論文タイトル | Irreversible evolutionary loss of chitin-degrading ability in the chitinase-like protein Ym1 under positive selection in rodents (和訳:げっ歯類のキチナーゼ様タンパク質 Ym1は正の選択下でキチン分解能力を不可逆的に喪失した) |
|---|---|
| 著者 | Kazuaki Okawa, Eri Tabata, Yuta Kida, Kyohei Uno, Hidetoshi Suzuki, Minori Kamaya, Peter O. Bauer, Fumitaka Oyama |
| 掲載誌 | Protein Science, 32, e4620, 2023. https://onlinelibrary.wiley.com/doi/10.1002/pro.4620 Protein Science は、The Protein Societyの Flagship Journal で、タンパク質のあらゆる科学的側面に関する独自の研究を報告する役割を果たしています。2021年度の Impact Factor は、6.993 です。 |
| 研究費 | 工学院大学総合研究所プロジェクト研究費 |